| هیدروژن کلرید | |||||
 |
|||||
 |
|||||
| شناسایی | |||||
|---|---|---|---|---|---|
| نام IUPAC | هیدروژن کلرید اسید هیدروکلریک |
||||
| شماره CAS _ | |||||
| شماره ECHA _ | 100,028,723 | ||||
| شماره EC _ | 231-595-7 | ||||
| ظاهر | گاز، بی رنگ، با بوی تند 1 . | ||||
| خواص شیمیایی | |||||
| فرمول | H Cl [ایزومرها] | ||||
| جرم مولی 3 | 0.002 ± 36.461 g / mol H 2.76٪، Cl 97.23٪، |
||||
| p K a | -4 | ||||
| لحظه دو قطبی | 0.000 ± 1.108 3 D2 | ||||
| مشخصات فیزیکی | |||||
| دمای ذوب | -114 درجه سانتیگراد 1 | ||||
| دمای جوش | در 101.3 کیلو پاسکال : -85 درجه سانتیگراد 1 | ||||
| انحلال پذیری | در آب 20 درجه سانتیگراد : 720 گرم · l -1 1 | ||||
| جرم حجمی | 1.49 گرم · لیتر -1 (گاز) 1
[+]
|
||||
| فشار بخار اشباع |
[+]
|
||||
| نقطه بحرانی | 51.35 درجه سانتی گراد ، 8.26 مگاپاسکال 5 | ||||
| نقطه سه گانه | 160 K ( -114 درجه سانتیگراد )، 13.8 کیلو پاسکال | ||||
| سرعت صدا | 296 m s -1 ( 0 ° C ، 1 atm ) 6 | ||||
| ترموشیمی | |||||
| گاز S 0 ، 1 بار | 186.90 J K -1 mol -1 _ _ | ||||
| گاز Δ f H 0 | 92.31 کیلوژول · مول -1 | ||||
| Δ vap H° | 16.15 کیلوژول · مول -1 ( 1 اتمسفر ، -85 درجه سانتیگراد ). 9.08 کیلوژول · مول -1 ( 1 اتمسفر ، 25 درجه سانتیگراد ) 7 |
||||
| ج ص | 29.14 J/mol K ( 25 درجه سانتیگراد )
[+]
|
||||
| موارد احتیاط | |||||
| GHS 9 | |||||
   خطر H314 و H331 [+]
|
|||||
| WHMIS 10 | |||||
   A، D1A، E، [+]
|
|||||
| NFPA 704 | |||||
|
2
3
1
|
|||||
| حمل و نقل | |||||
[+]
[+]
طبق فصل 2.2.2.2.2، کلرید هیدروژن، به شکل مایع در یخچال، برای حمل و نقل توسط ADR |
|||||
| استنشاق | به هوای تازه بیاورید، احتمالاً احیای قلبی ریوی | ||||
| پوست | لباس های کثیف را بردارید، با آب فراوان بشویید، به پزشک نشان دهید | ||||
| چشم ها | در حالی که پلک ها را باز نگه داشته اید با آب فراوان بشویید و به چشم پزشک نشان دهید | ||||
| گوارشی | به مردم نوشیدنی ندهید، استفراغ نکنید، با پزشک تماس بگیرید. | ||||
| اکوتوکسیکولوژی | |||||
| آستانه بو | کم: 0.25 ppm زیاد: 10.06 ppm 11 |
||||
|
|
|||||
| واحدهای SI و CNTP ، مگر اینکه خلاف آن ذکر شده باشد. | |||||
| برای اصلاح |
|||||
کلرید هیدروژن ، نماد شیمیایی H Cl ، جسمی متشکل از کلر و هیدروژن ، بی رنگ، سمی و بسیار خورنده است . در شرایط محیطی دما و فشار گازی است که در تماس با رطوبت دود سفید ایجاد می کند . این بخارها از اسید هیدروکلریک ، محلول یونی کلرید هیدروژن در آب تشکیل شده اند .
کلرید هیدروژن، مانند اسید هیدروکلریک ، یک ماده شیمیایی مهم در شیمی ، صنعت یا علم است. نام HCl گاهی به اشتباه به جای هیدروژن کلرید خالص به اسید کلریدریک اشاره دارد. گاهی اوقات شیمیدان ها از اسید هیدروکلریک گازی یا بی آب برای اشاره به کلرید هیدروژن صحبت می کنند.
تاریخچه هیدروژن کلرید
هیدروژن کلرید از قرون وسطی شناخته شده است ، جایی که کیمیاگران می دانستند که اسید کلریدریک (که در آن زمان به عنوان روح نمک یا اسیدوم سالیس شناخته می شد) در شرایط خاصی با بخارهایی به نام گاز اسید دریایی مرتبط است .
در قرن هفدهم ، یوهان رودولف گلابر از نمک ( کلرید سدیم ) و اسید سولفوریک برای ساخت سولفات سدیم با محصول جانبی واکنش هیدروژن کلرید استفاده کرد:
- 2 NaCl + H 2 SO 4 → 2 HCl + Na 2 SO 4.
این کشف گاهی به کارل ویلهلم شیله نسبت داده می شود که او نیز این واکنش را در سال 1772 انجام داد. جوزف پریستلی در سال 1772 کلرید هیدروژن خالص را به دست آورد و در سال 1818 هامفری دیوی نشان داد که این گاز از هیدروژن و کلر تشکیل شده است .
در طول انقلاب صنعتی ، تقاضا برای مواد قلیایی ، به ویژه کربنات سدیم، اهمیت فزاینده ای پیدا کرد. Nicolas Leblanc یک فرآیند صنعتی جدید برای تولید کربنات سدیم ایجاد کرد . در فرآیند Leblanc , نمک ( کلرید سدیم ) با استفاده از اسید سولفوریک , گچ و زغال سنگ به کربنات سدیم تبدیل می شود و با تولید ثانویه هیدروژن کلرید . تا زمان تصویب قانون قلیایی در پادشاهی متحده در سال 1863، قانون قلیایی به هوا رها شد. سپس تولیدکنندگان کربنات سدیم مجبور شدند آن را در آب حل کنند که این امر امکان تولید اسید کلریدریک را در مقیاس صنعتی فراهم کرد. بعدها، فرآیند هارگریوز ، مشابه فرآیند Leblanc توسعه یافت، با این تفاوت که اسید سولفوریک با دی اکسید گوگرد ، آب و هوا جایگزین می شود . در آغاز قرن بیستم ، فرآیند Leblanc با فرآیند Solvay جایگزین شد که کلرید هیدروژن تولید نمی کند. با این حال، کلرید هیدروژن هنوز یک مرحله در تولید اسید هیدروکلریک است .
شیمی هیدروژن کلرید

مولکول کلرید هیدروژن HCl یک مولکول دو اتمی متشکل از یک اتم هیدروژن H و یک اتم کلر Cl است که توسط یک پیوند منفرد به هم متصل شده اند . از آنجایی که کلر به طور قابل توجهی الکترونگاتیوتر از هیدروژن است، پیوند قطبی می شود. در نتیجه، مولکول دارای یک گشتاور دوقطبی بزرگ است که یک بار جزئی منفی δ- توسط اتم کلر و یک بار جزئی مثبت δ + توسط اتم هیدروژن حمل میشود . بنابراین کلرید هیدروژن یک مولکول قطبی است . در آب و حلال های قطبی بسیار محلول است .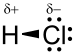
در تماس با آب، کلرید هیدروژن یونیزه می شود و آنیون های کلرید Cl- و کاتیون های هیدرونیوم H 3 O + ( H + حل شده ) را تشکیل می دهد :
- HCl + H 2 O → H 3 O + + Cl –
محلول حاصل از واکنش اسید کلریدریک نامیده می شود . این یک اسید قوی است به این معنی که ثابت اسیدیته Ka ( که با سرعت تفکیک مولکول HCl مرتبط است) بسیار زیاد است: کلرید هیدروژن تقریباً به طور کامل در آب تجزیه می شود.
حتی در غیاب آب، کلرید هیدروژن همچنان به عنوان یک اسید عمل می کند . برای مثال، HCl میتواند در حلالهای دیگری مانند متانول و یونها یا مولکولهای پروتونات حل شود و بهعنوان کاتالیزور اسیدی برای واکنشهای شیمیایی خاصی که شرایط بیآب (فقدان کامل آب) مورد نیاز است، عمل میکند:
- HCl + CH 3 OH → CH 3 O + H 2 + Cl –(پروتوناسیون توسط HCl یک مولکول متانول CH 3 OH)
به دلیل ماهیت اسیدی، کلرید هیدروژن یک گاز خورنده است ، به ویژه در حضور رطوبت ( 2 تا 5 پی پی ام آب کافی است).
تولید هیدروژن کلرید
بیشتر هیدروژن کلرید تولید شده در صنعت برای تولید اسید هیدروکلریک استفاده می شود .
یک روش متداول برای تولید کلرید هیدروژن در صنعت “کوره HCl” است که در آن دی هیدروژن و گاز دی کلر در یک واکنش گرمازا واکنش داده و کلرید هیدروژن را تشکیل می دهند:
این واکنش برای تولید یک محصول بسیار خالص، به ویژه برای صنایع غذایی استفاده می شود.
کلرید هیدروژن همچنین می تواند از دی کلر و ترکیبات حاوی هیدروژن مانند هیدروکربن ها تولید شود . کلرزنی ترکیبات آلی می تواند منجر به تولید کلرید هیدروژن شود:
واکنش محصولات کلردار با هیدروژن فلوراید برای تشکیل ترکیبات فلوئوردار نیز کلرید هیدروژن تولید می کند:
هنگامی که این واکنش ها در یک محیط بی آب (عدم وجود آب) انجام می شود، HCl گازی تشکیل می شود.
کلرید هیدروژن همچنین می تواند در مقیاس صنعتی از کلرید سدیم (NaCl) و اسید سولفوریک 12 تولید شود :
2 NaCl + H 2 SO 4 → 2 HCl + Na 2 SO 4 .
سنتز هیدروژن کلرید
کلرید هیدروژن را می توان با افزودن آهسته آب ( یا یک اسید ) به معرف های کلردار اضافی مانند کلریدهای فسفر ، تیونیل کلرید (SOCl2 ) یا کلریدهای آسیلی سنتز کرد . اضافه کردن بیش از حد آب می تواند منجر به حل شدن کلرید هیدروژن و تشکیل اسید هیدروکلریک شود . به عنوان مثال، افزودن آهسته آب سرد به پنتاکلرید فسفر منجر به تشکیل HCl زیر می شود:
افزودن آب داغ باعث می شود تا با هیدرولیز PCl 5 به اسید فسفریک، HCl بیشتری بدست آوریم . واکنش شیمیایی بین آب و تری کلرید فسفر PCl 3 نیز HCl تولید می کند.
واکنش تیونیل کلرید با آب باعث تولید HCl و همچنین دی اکسید گوگرد SO 2 می شود . برای واکنش های تیونیل کلرید یا کلرید آسیل با آب، به تیونیل کلرید و کلرید آسیل مراجعه کنید .
ژنراتور HCl
با استفاده از مولد هیدروکلراید با روش های مختلف می توان مقادیر کمی از HCl را برای استفاده آزمایشگاهی تهیه کرد :
- انتشار از اسید هیدروکلریک غلیظ با استفاده از اسید سولفوریک غلیظ .
- انتشار از اسید هیدروکلریک غلیظ با استفاده از کلرید کلسیم بی آب .
- با واکنش اسید سولفوریک و کلرید سدیم زیر : NaCl + H 2 SO 4 → NaHSO 4 + HCl ↑
به طور معمول، اسید کلریدریک یا اسید سولفوریک به صورت قطره ای به معرف در یک فلاسک اضافه می شود. HCl را می توان با حباب زدن آن از طریق اسید سولفوریک غلیظ خشک کرد.
استفاده می کند
کاربردهای تاریخی هیدروژن کلرید در طول قرن بیستم شامل هیدروکلرینه کردن آلکین ها برای تولید مونومرهای کلردار کلروپرن و وینیل کلرید است که سپس پلیمریزه می شوند تا پلی کلروپرن ( نئوپرن ) و پلی وینیل کلرید (PVC) بسازند . برای تولید وینیل کلرید، استیلن ( C2H2 ) تحت افزودن HCl بر روی پیوند سه گانه قرار می گیرد تا وینیل کلرید را تشکیل دهد.
“فرایند استیلن” که از دهه 1960 برای تولید کلروپرن استفاده شد، با واکنش دو مولکول استیلن آغاز می شود . واسطه بهدستآمده با افزودن HCl روی پیوند سهگانه که منجر به کلروپرن میشود، میشود:
فرآیند استیلن با فرآیندی جایگزین شد که در آن Cl 2 به یکی از پیوندهای دوگانه در 1،3- بوتادین اضافه میشود و به دنبال آن حذف میشود که کلروپرن و HCl تولید میکند.
در حال حاضر کاربردهای اصلی هیدروژن کلرید عبارتند از:
- در بیشتر موارد تولید اسید هیدروکلریک
- هیدروکلره لاستیک
- تولید وینیل کلرید و آلکیل کلرید
- پردازش پنبه
- صنعت نیمه هادی
اثرات سلامت

کلرید هیدروژن در تماس با بافت های بدن اسید هیدروکلریک تشکیل می دهد. استنشاق آن می تواند باعث سرفه، خفگی، التهاب دیواره بینی، گلو و سیستم تنفسی شود. در شدیدترین موارد، می تواند منجر به ادم ریوی ، نارسایی سیستم قلبی عروقی و مرگ شود. هیدروژن کلرید می تواند باعث سوختگی شدید چشم و آسیب غیرقابل برگشت چشم شود. فقط باید در اتاقی با تهویه مناسب و همراه با ماسک استفاده شود.

